Vücudumuzun Fısıltı Gazetesi: Eksozom
Yasemen Kesimoğlu
İnsan vücudunun her bileşeni birbiri ile ahenk içinde çalışmaktadır ve bu ahengin devamlılığı için iletişim şarttır. Yakın tarihte yapılan araştırmalar en küçük yapı birimi olan hücrelerin birbiriyle eksozomlar vasıtasıyla iletişim sağladığını göstermiştir. Eksozomlar için adeta hücreden hücreye gönderilen bir fısıltı gazetesi de denilebilir. Bu yazıda ise eksozomların oluşum mekanizması, yapısı ve insan vücudundaki fizyolojik ve patolojik rollerinin yanı sıra hücreler arası iletişim rollerinden doğan biyobelirteç potansiyellerine değinilecektir. Eksozomlardan bu denli geniş çapta bahsedilmesinin sebebi ise henüz gelişmekte olan bu alana dair temel bilgileri vererek doğası gereği kazandığı biyobelirteç potansiyelinin anlaşılmasına katkı sağlamaktır.
1. Eksozom Nedir?
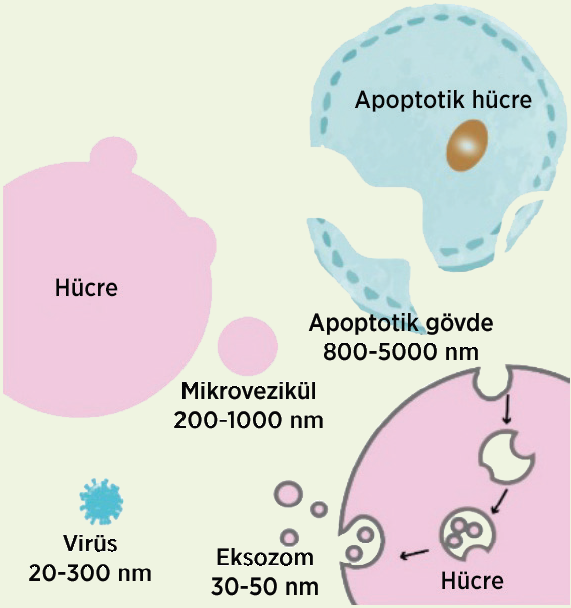
Eksozomlar hücreye ait biyolojik materyalleri hem yüzeyinde hem de içerisinde barındırabilen ekstraselüler veziküllerden biridir. Ekstraselüler veziküller temelde 3 çeşittir: apoptotik hücreler, mikro veziküller ve eksozomlar.Apoptotik hücreler ve mikro veziküller hücre zarından doğrudan dışa tomurcuklanmayla oluşurken, eksozomlar dolaylı yoldan üretilir.1 Ayrıca eksozomlar, her hücreden salgılanmakta ve idrar, kan, beyin omurilik sıvısı, amniyotik sıvı, sinoviyal sıvı, anne sütü gibi birçok vücut sıvısında bulunmaktadır.2 Temel aldıkları hücreye göre isimleri de değişkenlik gösterebilmektedir. Örneğin, eksozomlar kanser hücresi kökenli ise onkozom, dendritik hücre kaynaklı ise deksozom adını almaktadır.3
2. Eksozomun Biyogenezi
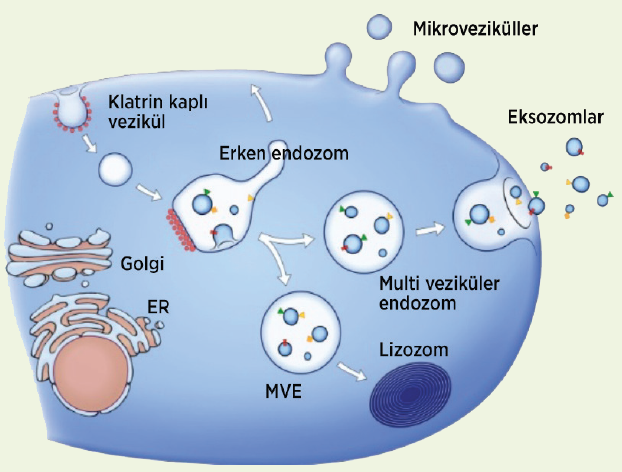
Eksozomlar endozomal yolak üzerinden oluşmaktadır. İlk olarak hücre zarında içe doğru tomurcuklanma ile erken endozom oluşmaktadır. Ardından golgi cisimciği aracılığıyla lümenlerinde veziküller birikerek (intra lüminal vezikül) geç endozoma dönüşmektedir. Bu işlemi çeşitli yolaklar üzerinden kargo içeriğinin yüklenmesi takip etmektedir. Taşıma için Gerekli Endozomal Sınıflama Kompleksleri [Endosomal Sorting Complexes Required for Transport] (GESK) bağımlı ve GESK bağımsız olmak üzere bilinen iki kargo yükleme mekanizması bulunmaktadır. Bu süreçte ikinci defa gerçekleşen içe doğru tomurcuklanma ile kargo yüklenen geç endozomların lümeninde çok sayıda vezikül oluşarak artık multi veziküler cisim adını almaktadır. Multi veziküler cisimler ise iki yoldan birini izlemektedir: içeriğinin yıkılması için lizozoma yönlendirilmek ya da hücre zarına penetre olarak içeriğindeki vezikülleri yani eksozomları hücre dışına salgılamak.1
3. Eksozom Yapısı ve İçeriği
Eksozomların salgılandığı hücreler farklılık göstermektedir. Dolayısıyla eksozomal içerik çeşitliliği ve miktarı da köken aldığı hücreye bağlı olarak değişmektedir. Fakat genel bir başlık altında topladığımızda eksozomların protein, lipid, nükleik asit ve çeşitli metabolitler içerdiği söylenebilir.4
a. Eksozomal Protein İçeriği
Eksozomlar yalnızca salgılandığı hücre tipine özgü proteinleri değil aynı zamanda belirli yolaklarda rol alan hücresel proteinlerin alt kümelerini de taşımaktadır. Örneğin hücre hedeflemekle birlikte adhezyondan sorumlu tetraspanin ve integrin (CD63, CD9, CD81, CD82 vb.); membran füzyonunda rol alan RabGTPaz, flotinin ve anneksin; moleküler şaperon olan ısı şok proteinleri (HSP) ve multi veziküler cisimlerin (MVC) biyogenezinden sorumlu tümör duyarlılık geni 101 proteini (TSG101) gibi protein gruplarının eksozomal protein içeriğini oluşturduğu bilinmektedir.1
b. Eksozomal Nükleik Asid İçeriği
Nükleik asitler hücreye ait genetik bilgi taşıyan ve bu bilgiyi işlevselleştiren moleküllerdir. Ribonükleik asid (RNA) ve deoksiribonükleik asid (DNA) eksozom içeriğinde sıkça rastlanan nükleik asid türevleridir. Mesajcı RNA (mRNA), mikro RNA (miRNA) içerik analizi yapıldığında ilk karşılaşılan RNA çeşitleri olurken eksozomal DNA hakkındaki çalışmalar son dönemlerde ağırlık kazanmıştır.1
c. Eksozomal Lipid İçeriği
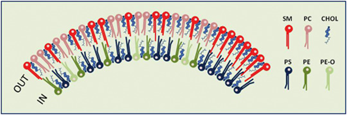
Eksozomlar çift zar yapısına sahip olup membran bileşiminde yapı taşı olarak lipitleri kullanmaktadır. Moleküler dinamik simülasyon tasarlayan araştırmacılar membranın iç ve dış yüzeyinde lipitlerin dağılımlarında farklılık olduğunu göstermiştir. Eksozomal zarın dış yüzeyinde sfingomiyelin başta olmak üzere fosfotidilkolin yoğunluğu artarken iç yüzeyde ise fosfatidilserin daha fazla olmakla beraber fosfatidiletanolamin miktarında artış görülmektedir. Ayrıca iç yüzeyde fosfatidiletanolaminin eterleri de yer almaktadır. Kolesterol ise diğer lipitlere nispeten daha homojen bir dağılımla hem iç yüzey hem de dış yüzeyde yerleşim gösterse de dış yüzeydeki miktarı iç yüzeye oranla artmaktadır.5
4. Eksozomun Fizyolojik ve Patolojik Görevi
Hücreler arası iletişimde rol alan eksozom, yüzeyindeki ve içeriğindeki materyaller dolayısıyla hedeflendiği ortamda fizyolojik ve patolojik süreçlerde etkili olabilmektedir. Eksozomlar parakrin, endokrin ve hatta otokrin etkileşimler yapabilmektedir.6 Bu etkilerin anlaşılması ve kontrol mekanizmalarının keşfedilmesinin hastalıkların teşhis ve tedavisinde etkin yöntemlerin ortaya çıkmasına katkı sağlayacağı öngörülmektedir.1
a. Eksozomun Fizyolojik Rolleri
Eksozomların bağışıklık, sinirsel iletişim, üreme ve gelişme, hücre proliferasyonu, homeostaz ve hücre olgunlaşması gibi süreçlerde aktivatör rol aldığı görülmüştür. Bağışıklık üzerinde eksozomların çok sayıda etkisi olduğu bulunmuştur. Eksozomlar makrofajları indükleyerek belirli proinflamatuar sitokinleri serbest bıraktırmakta ve tümör nekroz faktörlerinin (TNF) salımını arttırmaktadır.7,8 Aynı zamanda dendritik hücrelerin (DC) olgunlaşmasını desteklemekte9 ve doğal katil (NK) hücre aktivitesini arttırmaktadır.10 Ayrıca majör histo-uyumluluk kompleksi (MHC) peptit moleküllerinin teslimi11 ve antijenlerin sunumunda12 da rol alarak bağışıklığı aktive edici ve destekleyici etkilerinin olduğu anlaşılmıştır.
İletişim aracı olan eksozomlar organizmanın her noktasında olduğu gibi duyusal ve motor nöronlar, glial hücreler arasında da bu işlevini gerçekleştirmektedir.13 Bunların yanı sıra gamet olgunlaşması, döllenme ve embriyo implantasyonu gibi üreme süreçlerinde eksozomun etkileri araştırılmıştır. Yapılan çalışmalar eksozomların, anne ve fetüs arasındaki immün sistem yanıtını düzenleyerek gebeliğin sürdürülmesini ve fetüsün korunmasında görev aldığını ortaya çıkarmıştır.14 Gebelikle beraber embriyo üzerinde organogenez sürecinde ve hücre kutuplaşmasında da eksozomların etkin rolü olduğu keşfedilmiştir.15
Ayrıca hücre proliferasyonu, homeostaz ve hücre olgunlaşması gibi mekanizmalarda eksozomların rol aldığı görülmüştür. Eksozom temel aldığı hücrenin özeti olarak görüldüğünden aynı durumun kök hücreler açısından da geçerliliğini koruyacağı öngörülmüştür. Bu nedenle eksozomların kök hücrelerin alternatif aracıları olarak hareket edebileceği sonucuna varılmıştır.16 Hepatosit kaynaklı eksozomların, hedef hücrede sfingosin-1-fosfat oluşturmak için sfingosin kinaz 2’yi transfer ederek hücre proliferasyonu ve karaciğer rejenerasyonunu desteklediğini açıklayan araştırma buna örnek olarak verilebilir.17 Retikülosit olgunlaşma sürecinde ise eksozomlar istenmeyen yüklerin atılması için aracı olarak kullanılmıştır. Retikülositler eritrositlere olgunlaşmaya başladığında, transferrin reseptörleri, zarla ilişkili enzimler ve proteinler seçici olarak eksozomlar yoluyla çıkarılmaktadır.18 Bu da eksozomların bir yandan iletişim aracı olarak kullanıldığını, diğer yandan ise hücrenin gelişim süresince atık kutusu görevini de üstlenebileceğini göstermektedir.
b. Eksozomun Patolojik Rolleri
Eksozomların temel aldığı hücreye ait içerdiği bilgiler, her zaman olağan akışı yöneten materyaller olmayabilir. Bu açıdan yaklaşıldığında ise patolojik potansiyellerinin olduğu aşikâr olmaktadır. Bağışıklığı baskılamak, tümör ve nörodejeneratif hastalıkların beraberinde patojenik enfeksiyonların yayılmasında da taşıyıcı rolünde eksozomların etkili olduğu kanıtlanmıştır.1
Eksozomlar temel aldığı hücrede aktive olmuş mekanizmalara göre bağışıklığı baskılayıcı etki gösterebilmektedir. Bu etkiyi doğal katil hücrelerinin aktivitesini veya dendritik hücrelerin farklılaşmasını azaltarak, Fas ligand aracılığıyla T hücre apoptozunu indükleyerek, T lenfositlerin proliferasyon sürecini sekteye uğratarak ve eksozomal interlökin-10 eşliğinde enflamasyon yanıtının oluşmasını engelleyerek oluşturmaktadır.19
Nörodejeneratif hastalıklarda ise içerdiği proteinlerin sağlıklı dokuda yayılmasıyla hastalık gelişimine sebep verebilmektedir. Örneğin Alzheimer hastalığının gelişiminde etkili olduğu kanıtlanan amiloid-β peptidinin eksozomlar tarafından taşınarak nöronal hasarın şiddetlenmesine yol açtığı gösterilmiştir. Yalnızca amiloid-β peptidi değil aynı zamanda eksozomların içerdiği diğer toksik proteinlerin de bu süreçte etkili olduğu düşünülmektedir.20,21 Diğer önemli bir nörodejeneratif hastalık olan Parkinson’da ise α‑sinüklein proteininin enterik nöronlar gibi periferden başlayarak santral sistemini etkisi altına alması, bu süreçte eksozomal transferin rol oynadığını düşündürmektedir.22
Metabolik bozulmalara neden olan hastalık etkenlerinin yanı sıra patojenik enfeksiyonların bileşenleri de eksozom içeriğinde yer alabilmektedir. Örneğin virüsler hücre dışında canlılık faaliyeti sürdüremezken hücre içinde aktif olabilmektedir. Bununla birlikte hücrenin özeti olarak düşündüğümüz eksozomların, viral protein ve genom parçaları içermesi muhtemel bir düşüncedir. Buradan yola çıkarak araştırma yapan bilim insanları, eksozomların yalnız enfeksiyon etkenini yaymakla kalmayıp bağışıklık ve alıcı hücrenin tepkisinde modülasyona sebep olduğunu bulmuşlardır.1 Epstein-Barr virüsü (EBV) üzerinde yapılan araştırmada, eksozom aracılığıyla taşınan viral miRNA’ların enfekte olmamış hücrelerde EBV hedef genlerinin ekspresyonunu baskıladığı görülmüştür.23 Bir başka çalışma ise HIV‑1 kemokin reseptörü 5’in eksozom eşliğinde alıcı hücreye transferinin, virüsün girişine katkı sağladığı gösterilmiştir.24
Peki viral genom ve protein içeren eksozomları virüslerden nasıl ayırt edebiliriz? İlk olarak boyut karşılaştırması yapılabilir. Eksozom ve virüsler hücreden salınırken GESK yolağını kullansalar da eksozomlar 30-150 nm boyutunda iken virüsler 20-300 nm boyutlarındadır. İkinci husus eksozomlar her ne kadar viral protein ve genetik materyal içerse de virüslerden farklı olarak çoğalamazlar. Bu nedenle eksozomlar için çoğalma yeteneğini kaybetmiş virüsler de denilebilir.1
Hücre enfeksiyonlardan korunmak için çeşitli savunma mekanizmaları geliştirmiştir. Bunun ilk basamağı patojeni otofagozom içine alarak lizozoma iletmektir. Böylece enfeksiyon etkeni çevreden temizlenmiş olmaktadır. Buna karşın mikroorganizmalar otofaji üzerinde etkili genleri ve proteinleri hedefleyerek kendilerini korumaya almıştır.25 Nihayetinde ise hücre yeni bir savunma mekanizması olarak eksozomları kullanmaktadır. Lizozomal savunma yolağı hasar görmüş mesane epitel hücreleri üzerinden bu etkiyi inceleyen bilim insanları, Escherichia coli ile enfekte olan hücrelerin salgıladıkları eksozomlarda bakteriye ait materyallere rastlamışlardır.26
Eksozomlar hücreden salınan nano boyutlu, içerikleri ve yüzey molekülleri sebebiyle hücreye dair bilgi taşıyan yapılar olarak bilinmektedir. Adeta içimizde kulaktan kulağa dolaşan fısıltı gazetesi rolündeki eksozomun, kanser, nörolojik hastalıklar ve enfeksiyonlara dair tanı süreçlerindeki potansiyeli akıllara gelmektedir. Eksozomların bu avantajı kullanılarak daha etkin ve başarılı teşhislerin gerçekleştirilmesi mümkündür. Tüm bunlar için hastalıkların oluşum ve gelişim metabolizmalarının daha kesin bir şekilde aydınlatılmış olması ve eksozomun bu süreçlerde hangi aşamada devreye girdiğinin irdelenmesi gerekmektedir. Bugün edinmiş olduğumuz bilgiler ışığında ise gelecekte eksozomların tanı süreçlerinde aktif rol alacak bir bileşen olduğu aşikârdır.
Kaynakça
- He C, Zheng S, Luo Y, Wang B. Exosome Theranostics: Biology and Translational Medicine. Theranostics. 2018;8(1):237-255. doi:10.7150/THNO.21945
- Kahraman T, Güçlüler G, Gürsel İ. Eksozomlar: Tanı ve tedavide kullanılabilen doğal nanokesecik adayları. Turkish Journal of Immunology. 2013;2(2):34-40. doi:10.5606/tji.2014.323
- Ersöz E, Can OB, Uzunoğlu S. Eksozomların Kanserdeki Rolü. Vol 3.; 2016. Accessed May 2, 2021. https://dergipark.org.tr/en/pub/cbusbed/239313
- Raposo G, Stoorvogel W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 2013;200(4):373-383. doi:10.1083/jcb.201211138
- Skotland T, Sandvig K, Llorente A. Lipids in exosomes: Current knowledge and the way forward. Progress in Lipid Research. 2017;66:30-41. doi:10.1016/j.plipres.2017.03.001
- Ristorcelli E, Beraud E, Mathieu S, Lombardo D, Verine A. Essential role of Notch signaling in apoptosis of human pancreatic tumoral cells mediated by exosomal nanoparticles. International journal of cancer. 2009;125(5):1016-1026. doi:10.1002/IJC.24375
- Bhatnagar S, Schorey JS. Exosomes released from infected macrophages contain Mycobacterium avium glycopeptidolipids and are proinflammatory. Journal of Biological Chemistry. 2007;282(35):25779-25789. doi:10.1074/jbc.M702277200
- Vega VL, Rodríguez-Silva M, Frey T, et al. Hsp70 translocates into the plasma membrane after stress and is released into the extracellular environment in a membrane-associated form that activates macrophages. Journal of immunology (Baltimore, Md : 1950). 2008;180(6):4299-4307. doi:10.4049/JIMMUNOL.180.6.4299
- Skokos D, Botros HG, Demeure C, et al. Mast Cell-Derived Exosomes Induce Phenotypic and Functional Maturation of Dendritic Cells and Elicit Specific Immune Responses In Vivo. The Journal of Immunology. 2003;170(6):3037-3045. doi:10.4049/jimmunol.170.6.3037
- Gastpar R, Gehrmann M, Bausero MA, et al. Heat shock protein 70 surface-positive tumor exosomes stimulate migratory and cytolytic activity of natural killer cells. Cancer Research. 2005;65(12):5238-5247. doi:10.1158/0008-5472.CAN-04-3804
- Segura E, Amigorena S, Théry C. Mature dendritic cells secrete exosomes with strong ability to induce antigen-specific effector immune responses. Blood cells, molecules & diseases. 2005;35(2):89-93. doi:10.1016/J.BCMD.2005.05.003
- Wolfers J, Lozier A, Raposo G, et al. Tumor-derived exosomes are a source of shared tumor rejection antigens for CTL cross-priming. Nature medicine. 2001;7(3):297-303. doi:10.1038/85438
- Budnik V, Ruiz-Cañada C, Wendler F. Extracellular vesicles round off communication in the nervous system. Nature Reviews Neuroscience. 2016;17(3):160-172. doi:10.1038/nrn.2015.29
- Arck PC, Hecher K. Fetomaternal immune cross-talk and its consequences for maternal and offspring’s health. Nature medicine. 2013;19(5):548-556. doi:10.1038/NM.3160
- Jiang N, Xiang L, He L, et al. Exosomes Mediate Epithelium-Mesenchyme Crosstalk in Organ Development. ACS Nano. 2017;11(8):7736-7746. doi:10.1021/acsnano.7b01087
- Yáñez-Mó M, Siljander PRM, Andreu Z, et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 2015;4(2015):1-60. doi:10.3402/jev.v4.27066
- Nojima H, Freeman CM, Schuster RM, et al. Hepatocyte exosomes mediate liver repair and regeneration via sphingosine-1-phosphate. Journal of Hepatology. 2016;64(1):60-68. doi:10.1016/j.jhep.2015.07.030
- Johnstone RM, Adam M, Hammond JR, Orr L, Turbide C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). Journal of Biological Chemistry. 1987;262(19):9412-9420. doi:10.1016/s0021-9258(18)48095-7
- el Andaloussi S, Mäger I, Breakefield XO, Wood MJA. Extracellular vesicles: Biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 2013;12(5):347-357. doi:10.1038/nrd3978
- Bellingham SA, Guo BB, Coleman BM, Hill AF. Exosomes: Vehicles for the transfer of toxic proteins associated with neurodegenerative diseases? Frontiers in Physiology. 2012;3 MAY. doi:10.3389/fphys.2012.00124
- Perez-Gonzalez R, Gauthier SA, Kumar A, Levy E. The exosome secretory pathway transports amyloid precursor protein carboxyl-terminal fragments from the cell into the brain extracellular space. Journal of Biological Chemistry. 2012;287(51):43108-43115. doi:10.1074/jbc.M112.404467
- Emmanouilidou E, Melachroinou K, Roumeliotis T, et al. Cell-produced alpha-synuclein is secreted in a calcium-dependent manner by exosomes and impacts neuronal survival. The Journal of neuroscience : the official journal of the Society for Neuroscience. 2010;30(20):6838-6851. doi:10.1523/JNEUROSCI.5699-09.2010
- Pegtel DM, Cosmopoulos K, Thorley-Lawson DA, et al. Functional delivery of viral miRNAs via exosomes. Proceedings of the National Academy of Sciences of the United States of America. 2010;107(14):6328-6333. doi:10.1073/pnas.0914843107
- Mack M, Kleinschmidt A, Brühl H, et al. Transfer of the chemokine receptor CCR5 between cells by membrane-derived microparticles: a mechanism for cellular human immunodeficiency virus 1 infection. Nature medicine. 2000;6(7):769-775. doi:10.1038/77498
- Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation. Nature. 2011;469(7330):323-335. doi:10.1038/NATURE09782
- Miao Y, Li G, Zhang X, Xu H, Abraham SN. A TRP Channel Senses Lysosome Neutralization by Pathogens to Trigger Their Expulsion. Cell. 2015;161(6):1306-1319. doi:10.1016/J.CELL.2015.05.009