Mikroorganizmalar Sinirlerimize Dokunabilir
Büşra Yılmaz – Sultan Gül
https://www.npr.org/sections/health-shots/2013/11/18/244526773/gut-bacteria-might-guide-the-workings-of-our-minds
Her birimiz kendi içinde milyarlarca mikroorganizmaya ev sahipliği yapan bir ekosistemiz. Organizmanın dış çevre ile etkileşimde olduğu sindirim sistemi, solunum sistemi, sinir sistemi gibi vücut bölümleri, dinamik tek hücreli organizmalar topluluğu tarafından kuşatılmış durumdadır. İlgili organlar ekosistemin farklı bölgelerini temsil ederken, bu bölgelere özgü görülen mikroorganizma türleri de bu ekosistemdeki canlılar olarak kabul edilebilir. Vücudumuz bu mikroorganizmalara ev sahipliği yapmaktadır ve bu mikroorganizmalar sinir sistemine etkilerini Merkez Sinir Sistemi (MSS) içerisinde göstermektedir. Nörodejeneratif hastalıklar ve mikrobiyota ilişkisinin incelendiği pek çok çalışmada, bağırsak mikrobiyal metabolit profilinin değiştiği görülmüştür.1 Bu ilişkinin esas nedeni bilinmemektedir. Bununla birlikte değişen mikroorganizma popülasyonunun, hastalıkların teşhis ve tedavisine katkı sağlayabileceği düşünülmektedir.2 Bu derlemede, bağırsak mikrobiyotasının merkezi sinir sistemine ve merkezi sinir sisteminin de bağırsak mikrobiyotasına olan etkilerine çift yönlü olarak değinilecek, nörolojik hastalıklardan biri olan Alzheimer Hastalığının (AH) teşhisinde kullanılabilecek metabolit biyobelirteçlerini ele alan son çalışmalara odaklanılacaktır.
Bağırsak Mikrobiyotasının Merkezi Sinir Sistemine Etkisi
Bir organizmada yaşayan konakçı topluluğunun tümüne birden mikrobiyota denir. Tahmini olarak trilyonlarca tek hücreli canlıdan meydana gelen bağırsak mikrobiyotası ise, bilim insanları tarafından yeni bir organ olarak nitelendirilmiştir.1 Bu mikro canlılar hem birbirleriyle hem de konak canlı ile etkileşim halindedir. Bağırsak lümeninin mukus tabakasında yerleşmiş bakteri türleri ile bağırsak hücreleri arasında doğrudan ilişki kurulurken, bazı bakterilerde üretilen ürünler kan dolaşımına verilerek tüm vücut kısımlarına ulaşır.1 Mikrobiyotada çeşitliliğin artması genellikle sağlıklı bir durum olarak kabul edilirken, patolojik durumların çoğunda mikroorganizma çeşitliliğinin azaldığı ve buna mukabil patojen mikroorganizma istilasının olduğu gözlenmiştir.2 Birden fazla farklı mikroorganizmanın birlikte yaşadığı duruma simbiyoz (symbiosis) adı verilir. Bu ilişkide ikinci organizmanın yani konuk canlının yerleşme, yaşama ve çoğalmasına olanak tanıyan canlıya konak canlı denir. Konak organizmalar, sağlıklı durumda bakteri topluluklarını (kommensal-patojen) dengede tutmaya çalışır. Dengenin sağlandığı duruma biyozis, dengenin bozulduğu duruma ise disbiyozis adı verilir. Disbiyozis durumunda çeşitli hastalıkların ortaya çıktığı bilinmektedir. Bu hastalıkların yanı sıra nörolojik hastalıklar da mikrobiyotadaki değişiklikler ile ilişkilendirilmiştir.2 Peki bu ilişkinin temelinde ne yatar? Organizmanın bağırsak mikrobiyotasında ortaya çıkan değişiklikler, nörolojik hastalıkların tetiklenmesine mi neden olmaktadır?
İnsan bağırsak mikrobiyotasının sahip olduğu gen sayısı insan genomundan yüz kat fazladır.3,4 Bu bilgi toplam mikroorganizma sayısından daha ilgi çekicidir. Çünkü konuk canlı, konak organizmada yaşarken genomundaki, DNA dizisi olan genler fonksiyonel proteinlere dönüştürülür ve sonuçta mikrobiyal metabolit adı verilen protein yapılı ürünler üretilir.3 Mikrobiyomun konak canlıdan farklı olarak gerçekleştirdiği gen ifadesi, konak canlının birçok hayati işlevinin gerçekleştirilmesinde aracılık eder. Örneğin insan bağırsağında yaşayan bakterilerden bazıları esansiyel aminoasitler, hormon öncülleri (serotonin) veya vitaminler gibi ürünler üretir.4 Bu bakımdan simbiyotik bakterilerin tür çeşitliliği, organizmanın yararınadır. Kolona ulaşan lifli besinler gibi karbonhidrat türevli besinler, mikroorganizmalar tarafından fermente edilebilir. Bu reaksiyon sonucunda propiyonat, bütirat, asetat gibi Kısa Zincirli Yağ Asitleri (KZYA) oluşur. Bu KZYA’ların büyük bir çoğunluğu kolon epitel hücreleri tarafından enerji kaynağı olarak kullanılır.5 Kolon epitel hücrelerinin kullanmadığı, arta kalan metabolitler portal venden geçerek karaciğere ulaşır, oradan da tüm dolaşım sistemini geçerek ilgili hücreler üzerinde etki gösterir. MSS hücreleri de bu etki kapsamına girmektedir. KZYA’ların, Kan Beyin Bariyerini (KBB) geçerek mikroglia ve beyin dokusu homeostazı ve beyin gelişimi olaylarının yanında davranış modülasyonunu sağlayarak MSS’yi etkileyebildiği gösterilmiştir.6
Beyin ve bağırsak arasındaki ilişki bununla da sınırlı değildir. Beyin-bağırsak aksı çift yönlü bir etkileşim ağıdır.6 Bu etkileşimin en bilinen hali ise merkezi ve enterik sinir sistemi arasındaki nörotransmitter iletimidir. Gastrointestinal sistemin duvarında yerleşik bulunan milyonlarca nöron hücresinin oluşturduğu sisteme enterik sinir sistemi denir. Bu yolda çift taraflı elektriksel sinyaller ile iletişim kurulur. Bu iki iletişim yolu haricinde endokrin, hümoral, metabolik ve immün yollar da bu aksta görev alır. Yapılan çalışmalar enterik mikrobiyotanın beyin-bağırsak aksını etkilediğini göstermiştir.6 Beyin-bağırsak ekseninin toplamda 4 ana yolu (nörolojik, endokrin, hümoral/metabolik ve bağışıklık) aydınlatılmış olup, bu yollar ve etkileşim şekilleri aşağıda açıklanmıştır.
Nörolojik yolak; vagus siniri, enterik sinir sistemi ve gastrointestinal yol içindeki nörotransmitterlerin aktivitesini içerir. Endokrin yolak, bağırsak mikrobiyotasındaki besin varlığını değiştirerek enteroendokrin hücrelerden biyolojik olarak aktif peptitlerin salımını etkiler. Hümoral/metabolik yolakta ise bakteriyel metabolitler etkili olup, (en önemlileri, diyet karbonhidratlarının bakteriyel fermantasyonu sonucu üretilen KZYA’dır), bu bakteriyel metabolitler sinir sistemini dolaşım sistemine geçen hormonlar aracılığıyla etkilemektedir.7 Hümoral yolağı etkileyen en temel faktör, disbiyoz zamanlarında sitokinlerin ve interferon-gama gibi diğer hücresel iletişim araçlarının bağırsak mikrobiyomundan salınmasıdır.8 Ek olarak bağışıklık sistemi aracılığı ile, bağırsak mikrobiyotasını dolduran bakteriler, proinflamatuar sitokinlerin üretimine katkıda bulunabilecek büyük miktarda amiloid ve lipopolisakkarit salgılayabilir.9
Önemli bir nörotransmitter olan serotoninin yaklaşık %95’i bağırsaklardaki bakteriler tarafından üretilir. Geçirgen bağırsak sendromunda, bağırsak epitelindeki sıkı bağlantılı hücrelerin geçirgenlik kusurları nedeniyle, enterik bakterilerin hücre duvarında bulunan lipopolisakkarit (LPS), sistemik dolaşıma giriş yapabilir. Bağışıklık hücreleri bu durumda savunma olarak, LPS’lere karşı antikorlar üretir. Yapılan çalışmalarda bu antikor seviyelerinin majör depresyon hastalarında kontrol grubuna göre daha yüksek olduğu gösterilmiştir.10 Enterik enfeksiyonların, anksiyete, depresyon ve bilişsel işlev bozukluğuna neden olabileceği bilinmektedir.11,12 Yapılan bir çalışmaya göre, laboratuvar koşullarında özel olarak üretilen bağırsak mikrobiyotası olmayan yani mikroorganizma içermeyen (germfree) fareler, konvansiyonel farelere kıyasla stres duyarlılığı ve kaygıda azalmanın göstergesi olan davranışsal değişiklikler göstermektedir.11 Bu bulguların aksine, spesifik patojen içermeyen farelere kıyasla germfree farelerin, alıştırıldıkları labirent içerisinde anksiyete benzeri davranışlar sergiledikleri görülmüştür. Bu bulgulara dayanılarak geleneksel bağırsak mikrobiyotasının varlığının veya yokluğunun davranış gelişimini etkilediği ve bu değişikliğe, beyindeki nörokimyasal değişikliklerin eşlik ettiği sonucuna ulaşılmıştır.12
Beslenme tarzı değişiklikleri öncelikle mikrobiyotayı, dolaylı olarak da sinir sistemini etkileyebilmektedir. Yapılan bir çalışmada Batı Diyeti’nin kommensal bakteriler tarafından endotoksin üretimini arttırdığı bulunmuştur. Bu da nöroinflamasyonu ve bilişsel işlev bozukluğunu teşvik etmektedir. Bağırsak mikrobiyotasındaki diyete bağlı değişikliklerin, hipokampal nöronal düzensizliklere neden olduğu gösterilmiştir.13
Yapılan bir diğer çalışmaya göre ise, bağırsak mikrobiyotası, KBB’nin daha geçirgen hale geldiği yaşlanma sırasında, AH patogenezine katkıda bulunabilecek muazzam miktarda LPS’ler ve amiloidler salgılayabilmektedir. LPS/amiloidle tetiklenen sitokinler veya normal olarak taşınan diğer küçük proinflamatuar moleküller KBB’den geçebilmektedir.14
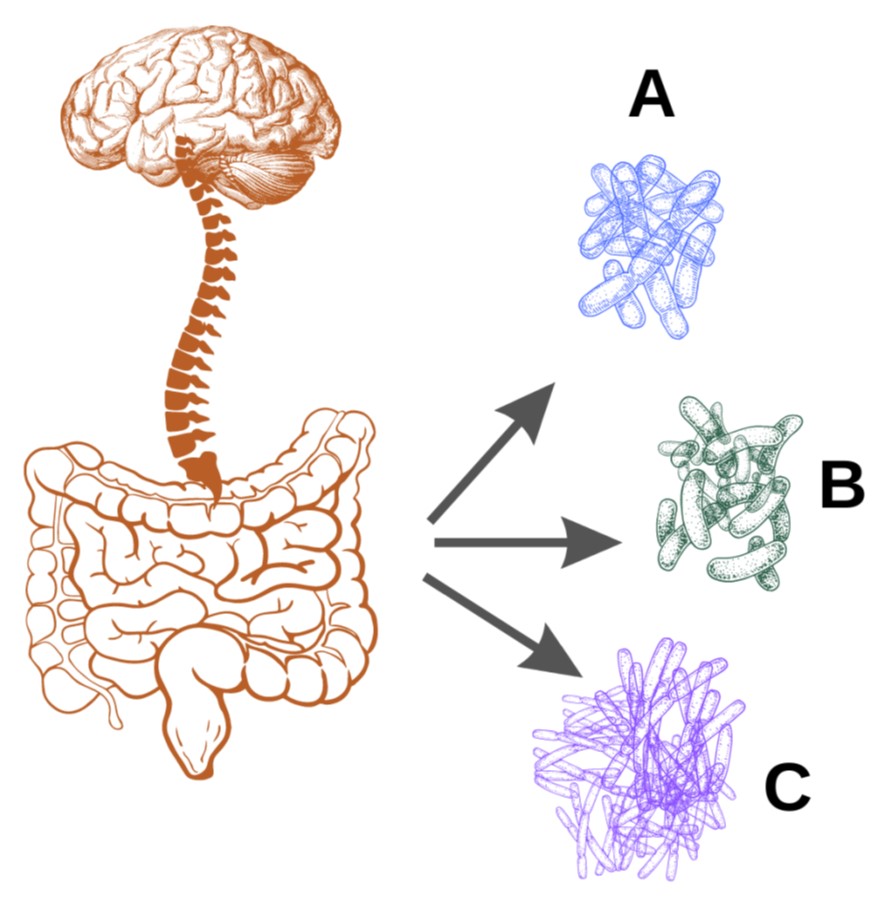
AH’li bireylerde tüm bağırsak mikrobiyotasına ilişkin kapsamlı bir araştırma yapılmamıştır. Ancak yapılan bir çalışmaya göre AH’li katılımcılarda, sağlıklı katılımcılara göre bazı mikroorganizmaların yoğunluğunda farklılık görülmektedir. Yapılan bir çalışmada Firmicutes ve Actinobacteria yoğunluğu azalırken Bacteroidetes yoğunluğunun arttığı görülmüştür (Şekil 1). 15
Merkezi Sinir Sisteminin Bağırsak Mikrobiyotasına Etkisi
Nörolojik hastalıklar içerisinde en sık görülen demans, yaklaşık 55 milyon insana eşlik etmekte ve her geçen yıl bu sayıya 10 milyon yeni vaka eklenmektedir.16 Nörolojik hastalıkların neden olduğu maliyet düşünüldüğünde hastalığa yakalanmadan önce teşhis yöntemlerinin geliştirilmesi, tedavi maliyetlerini düşürücü bir faktör olarak göze çarpmaktadır. Durum böyle iken nörolojik bir rahatsızlıkta bağırsak mikrobiyotasının ve çeşitli vücut sıvılarının moleküler bileşenleri büyük bir değişiklik göstermektedir. Ancak sürecin nasıl ilerlediği MSS’nin bağırsak mikrobiyotasını nasıl etkilediği tam olarak aydınlatılmış değildir: Nörolojik hastalıklar bağırsak mikrobiyotasının değişmesini mi tetiklemektedir?
Mikrobiyal değişimin esas nedeni bilinmemekle beraber bu değişikliğin nörolojik hastalığın seyrine etki ettiği düşünülmektedir. Nörolojik hastalıklar, Alzheimer ve diğer demanslar, Parkinson hastalığı (PH), multipl skleroz (MS), epilepsi ve baş ağrısı bozuklukları (migren, gerilim tipi baş ağrısı) gibi beyin ile ilgili çeşitli hastalıkları kapsamaktadır. Bu hastalıklar dünya çapındaki hastalık yükünün yüzde 3’ünü temsil etmektedir. Bununla birlikte beyinle ilgili çeşitli hastalıklar, Sakatlığa Ayarlanmış Yaşam Yılları (DALY) [Disability-Adjusted Life Year]’nın ilk 50 nedeni arasında yer alır.17 DALY, sağlıklı olarak geçirilen bir yılın kaybı olarak değerlendirilir ve toplum sağlığının ölçüm özetinin, örneğin mortalitenin ve ölümcül olmayan sağlıksız durumların tek bir sayı ile temsil edilmesi için geliştirilen bir ölçüttür. DALY, ölümle sonuçlanmayan ancak uzun süreli engellilik ile işlev kaybı yaratan hastalık durumlarının yol açtığı hastalık yükünün ölçülmesinde kullanılmaktadır.18
Günümüzde nörodejeneratif hastalıklarla ilişkili morbidite artmakta ve insanların zihinsel ve fiziksel yaşam kalitesi için bir tehdit oluşturmaktadır. AH, PH, Huntington hastalığı ve MS dahil olmak üzere NH’lar, beyindeki nörotoksik maddelerle ilişkili nöron kaybı ile karakterize hastalıklardır. AH biliş, hafıza ve motor yeteneklerin kaybı ile seyreden geri dönüşümsüz hastalıklardan biridir. AH’nin ayırt edici özelliği, beyinde hücre dışı Aβ plaklarının ve hücre içi hiperfosforile tau yumaklarının birikmesidir, diğer nöropatolojik belirtiler ise nöronların ölümü ve beyin atrofisini içerir.19
NH’lere ait biyobelirteçlerin varlığı çeşitli vücut sıvılarında araştırılmaktadır. Bunlardan biri olan nörofilament hafif zincir, birçok çalışmada, hem beyin omurilik sıvısı (BOS)’nda hem de serum/plazmada nörodejeneratif bozuklukların biyolojik belirteci olarak görülmektedir.20 Diğer biyobelirteçler, vasküler hücre adezyon molekülü, hücreler arası adezyon molekülü gibi hücre adezyon molekülleridir. Alzheimer hastalarında bu biyobelirteçlerin plazma seviyelerinde artış gözlenmiştir.21

Alzheimer ve benzeri nörodejeneratif hastalıkların beyin dışı biyobelirteçlerinin varlığı son yıllarda yapılan çalışmalarda sıklıkla araştırılmaktadır. Bu biyokimyasal biyobelirteçler doku, BOS veya kan örneklerinden elde edilebilir. Tanımına göre bir “biyobelirteç”; normal biyolojik süreçlerin, patojenik süreçlerin veya terapötik müdahaleye verilen farmakolojik yanıtların bir göstergesi olarak objektif olarak ölçülebilen ve değerlendirilebilen bir özelliktir. Bununla birlikte, teşhis amacıyla doku bazlı biyopsileri elde etmedeki zorluk nedeniyle, kan ve BOS biyobelirteçleri dahil olmak üzere biyolojik sıvıların kullanımı, MSS ile ilişkili bozukluklarda sıklıkla kullanılmaktadır.20
Yapılan in vivo bir çalışmada, mikrop içermeyen farelerde amigdala hacminin arttığı görülmüştür. Ancak AH için risk faktörü olan tip 2 diyabette, bağırsak mikrobiyotasındaki değişiklikler göze çarpmaktadır. Ancak AH’de bu durumun önemli olup olmadığı açık bir sorudur.22
AH’de bağırsak mikrobiyotasında değişiklikler bildirilmiştir. Bu da mikrobiyotanın AH ilerlemesine katkıda bulunabileceğini düşündürmektedir. Mikrobiyota manipülasyonları, periferik bağışıklık hücrelerinin MSS iltihabı ve tau aracılı nörodejenerasyon üzerindeki değişiklikleri etkilemektedir. Nörojenez ve miyelinasyon gibi temel nöral süreçlerin düzenlenmesinde mikroglianın mikrobiyom aktivasyonu etkilidir. AH’li bireylerin beyinlerinde beyin hasarına katkıda bulunan yüksek düzeyde iltihaplanma görülmüştür ki bunun nedeni mikroglia olarak bilinen bir bağışıklık hücresinin aktivasyonudur. Mikroglianın bağırsak mikrobiyomu tarafından düzenlendiği bilinmektedir. Yapılan bir çalışmada da mikropsuz farelerin neden daha düşük aktif mikroglia seviyelerine sahip olduğu açıklanmıştır.23
Bağırsak mikrobiyotası ve beyin, çeşitli mikrobiyal metabolitleri içeren bağışıklık sistemi ve enterik sinir sistemi yoluyla birbirleriyle iletişim kurar. Enfeksiyon, doğum şekli, antibiyotik ilaçların kullanımı, beslenmenin doğası, çevresel stresörler ve konak genetiği dahil olmak üzere birçok faktör, erken yaşamda mikrobiyota kompozisyonunu etkileyebilir. Yaşamın diğer ucunda, mikrobiyal çeşitlilik yaşlandıkça azalır. Özellikle stres, yaşamın her aşamasında mikrobiyota-bağırsak-beyin eksenini önemli ölçüde etkileyebilir. Son zamanlarda yapılan çalışmaların seyri de bağırsak mikrobiyotasının otizm, anksiyete, şizofreni, Parkinson ve Alzheimer gibi nörodejeneratif hastalıklar ile olan ilişkisine değinmektedir. Beyin-bağırsak aksının çift yönlü olarak birbirini etkilediği, beyindeki herhangi bir değişikliğin bağırsak mikrobiyomunu pozitif veya negatif olarak yönlendirdiği çeşitli çalışmalarla desteklenmeye devam etmektedir. Bağırsak mikrobiyotasında meydana gelen mikroorganizma dalgalanmalarının davranış gelişiminde birtakım değişikliklere neden olması, bunun sonucunda da beyinde nörokimyasal değişikliklerin meydana gelmesi süreci hala tam olarak aydınlatılmış değildir. Gelecek çalışmalar, başlangıç noktası denilebilecek ilk mekanizmanın tetiklediği diğer süreçler üzerine yoğunlaşabilir. Çeşitli biyobelirteçlerin bu hastalıklardaki rolünü her geçen gün daha detaylı olarak ele alabilmekteyiz. Yeni biyobelirteçler ile kanser, nörodejeneratif hastalıklar, kardiyovasküler hastalıklar ve diyabet gibi alanlarda daha etkili teşhis konulması mümkün görünmektedir. Mevcut çalışmalar göz önüne alındığında bağırsak mikrobiyotasının ikinci beyin olarak değerlendirilmesi görüşü yanlış bir yaklaşım olmayacaktır. Dolayısıyla bu küçük canlıların ve yaşamsal faaliyetlerinin kendi yaşam kalitemizi belirleyen bir anahtar görevi gördüğünü söyleyebiliriz.
Kaynakça
- Belizário JE, Faintuch J. Microbiome and Gut Dysbiosis. Exp Suppl. 2018;109:459-476. doi:10.1007/9783-319-74932-7_13.
- Sommer F, Bäckhed F. The gut microbiota-masters of host development and physiology. Nat Rev Microbiol. 2013;11(4):227-238. doi:10.1038/nrmıcro2974.
- Huttenhower C, Gevers D, Knight R, vd. Structure, function and diversity of the healthy human microbiome. Nature 2012 486:7402. 2012;486(7402):207214. doi:10.1038/nature11234.
- O’Hara AM, Shanahan F. The gut flora as a forgotten organ. EMBO Rep. 2006;7(7):688. doi:10.1038/ sj.embor.7400731.
- Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006;444(7122):1027-1031. doi:10.1038/nature05414.
- O’Riordan KJ, Collins MK, Moloney GM, vd. Short chain fatty acids: Microbial metabolites for gut-brain axis signalling. Mol Cell Endocrinol. 2022;546. doi:10.1016/j.mce.2022.111572.
- Carabotti M, Scirocco A, Maselli MA, Severi C. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems. Annals of Gastroenterology : Quarterly Publication of the Hellenic Society of Gastroenterology. 2015;28(2):203.
- Appleton J. The Gut-Brain Axis: Influence of Microbiota on Mood and Mental Health. Integrative Medicine (Encinitas). 2018;17(4):28-32.
- Jiang C, Li G, Huang P, Liu Z, Zhao B. The Gut Microbiota and Alzheimer’s Disease. Journal of Alzheimer’s Disease. 2017;58(1):1-15. doi:10.3233/jad-161141.
- O’Connor JC, Lawson MA, André C, vd. Lipopolysaccharide-induced depressive-like behavior is mediated by indoleamine 2,3-dioxygenase activation in mice. Mol Psychiatry. 2009;14(5):511-522. doi:10.1038/sj.mp.4002148.
- Olivares M, Neef A, Castillejo G, vd. The HLA-DQ2 genotype selects for early intestinal microbiota composition in infants at high risk of developing coeliac disease. Gut. 2015;64(3):406-417. doi:10.1136/ gutjnl-2014-306931.
- Neufeld KM, Kang N, Bienenstock J, Foster JA. Reduced anxiety-like behavior and central neurochemical change in germ-free mice. Neurogastroenterol Motil. 2011;23(3). doi:10.1111/J.13652982.2010.01620.x
- Noble EE, Hsu TM, Kanoski SE. Gut to Brain Dysbiosis: Mechanisms Linking Western Diet Consumption, the Microbiome, and Cognitive Impairment. Front Behav Neurosci. 2017;11(9). doi:10.3389/fnbeh.2017.00009.
- Hauss-Wegrzyniak B, Vraniak PD, Wenk GL. LPS-induced neuroinflammatory effects do not recover with time. Neuroreport. 2000;11(8):17591763. doi:10.1097/00001756-200006050-00032.
- Vogt NM, Kerby RL, Dill-McFarland KA, vd. Gut microbiome alterations in Alzheimer’s disease. Scientific Reports 2017 7:1. 2017;7(1):1-11. doi:10.1038/s41598-017-13601-y.
- World Health Organization (WHO). Dementia. https://www.who.int/news-room/fact-sheets/detail/dementia#:~:text=Key%20facts,nearly%2010%20million%20new%20cases Erişim Tarihi: 18 Nisan 2023.
- Thakur KT, Albanese E, Giannakopoulos P, vd. Neurological Disorders. Disease Control Priorities, Third Edition (Volume 4): Mental, Neurological, and Substance Use Disorders. Published online March 14, 2016:87-107. doi:10.1596/978-1-4648-0426-7_ch5.
- Arslan DT, Ağırbaş İ. Sağlık Çıktılarının Ölçülmesi: QALY ve DALY. Sağlıkta Performans ve Kalite Dergisi. 2017;13(1):99-126.
- Zhang H, Chen Y, Wang Z, vd. Implications of Gut Microbiota in Neurodegenerative Diseases. Front Immunol. 2022;13:325. doi: 10.3389/fimmu.2022.785644.
- Alirezaei Z, Pourhanifeh MH, Borran S, Nejati M, Mirzaei H, Hamblin MR. Neurofilament light chain as a biomarker, and correlation with magnetic resonance imaging in diagnosis of CNS-related disorders. Mol Neurobiol. 2020;57(1):469. doi:10.1007/ s12035-019-01698-3.
- Humpel C. Identifying and validating biomarkers for Alzheimer’s disease. Trends Biotechnol. 2011;29(1):26-32. doi:10.1016/j.tıbtech.2010.09.007.
- Dinan TG, Cryan JF. Gut instincts: microbiota as a key regulator of brain development, ageing and neurodegeneration. J Physiol. 2017;595(2):489. doi:10.1113/jp273106.
- Seo DO, O’Donnell D, Jain N, vd. ApoE isoform- and microbiota-dependent progression of neurodegeneration in a mouse model of tauopathy. Science (1979). 2023;379(6628). doi: 10.1126/science. add1236.